Im Alltag macht man sich wenig Gedanken darüber, wie unterschiedlich Wasser aussehen kann – es kann flüssig aus der Leitung kommen, gasförmig, wenn Wasser verdampft oder im Sommer als Eiswürfel in der Cola.
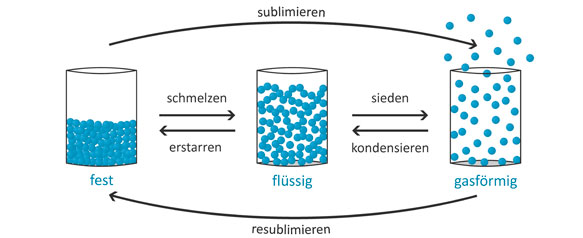
Physikalisch gesehen sind das die verschiedenen Aggregatzustände von Wasser: Als Eis nimmt es einen festen, als Wasser einen flüssigen und als Wasserdampf einen gasförmigen Zustand ein. Das sind auch die drei klassischen Aggregatzustände. Die meisten Stoffe kommen in verschiedenen Aggregatzuständen vor. Welcher gerade vorliegt, hängt dabei von verschiedenen Faktoren ab: vom Stoff selbst und seinen individuellen Eigenschaften, von der Temperatur und vom Umgebungsdruck.
Chemisch bleibt der Stoff derselbe – es ändern sich nur die physikalischen Bedingungen und damit der Aggregatzustand. Wie lassen sich die Unterschiede zwischen diesen drei Zuständen gut beschreiben? Das geht recht einfach mit den Begriffen Volumen und Form:
- Ein fester Stoff hat in der Regel ein nahezu festes Volumen und eine feste Form. Sie lassen sich nur schwer verformen.
- Ein flüssiger Stoff hat auch ein festes Volumen, aber keine feste Form. Vielmehr passt er sich immer der Form der jeweiligen Umgebung an.
- Ein gasförmiger Stoff hingegen hat weder ein festes Volumen noch eine feste Form – er verteilt sich immer komplett in dem Raum, der zur Verfügung steht.
Prinzipiell lässt sich sagen: Wenn ein Stoff seinen festen Zustand hat, ist auch die Dichte am größten – und als Gas ist die Dichte am niedrigsten.